我们围绕 “创新驱动” 与 “患者可及”,构建了多元化协同互补的产品组合,绝大部分产品均通过自有平台自主开发,含多个潜在“全球新”靶点药物,覆盖恶性肿瘤、自身免疫系统疾病、慢性代谢类疾病、神经系统疾病以及感染性疾病这五大治疗领域。
随着产品管线的不断丰富和对药物联合治疗的进一步探索,我们的创新研发领域从单抗药物扩展至包括小分子药物、多肽类药物、抗体药物偶联物(ADCs)、双特异性或多特异性抗体药物、核酸类药物等更多类型的药物研发以及癌症、自身免疫性疾病的下一代创新疗法探索。
产品管线
- 肿瘤
- 自身免疫
- 慢性代谢
- 神经系统
- 感染
- 全球开发
-
JS001sc
PD-1
肿瘤
公司在特瑞普利单抗基础上开发的皮下注射制剂
-
JS015
DKK1
肿瘤
JS015是公司独立自主研发的重组人源化抗DKK1单克隆抗体注射液,主要用于晚期恶性实体瘤的治疗。截至目前,国内外尚无同类靶点产品获批上市。
-
JS112
Aurora A
小细胞肺癌
公司与微境生物共同开发的口服小分子Aurora A抑制剂。截至目前,全球尚无Aurora A抑制剂获批上市
-
JS003
PD-L1
肿瘤
公司自主研发的人源化抗PD-L1单克隆抗体
-
JS019
CD39
肿瘤
公司与恩瑞尼生物成立合资公司共同研发的重组全人源抗CD39单克隆抗体
-
JS113
EGFR 4th Gen
非小细胞肺癌
公司与微境生物共同开发的潜在first-in-class第四代EGFR抑制剂,拟用于EGFR突变非小细胞肺癌和其他实体瘤的治疗
-
JS006(TAB006)
TIGIT
肿瘤
公司自主研发的重组人源化抗TIGIT单克隆抗体
-
JS101
Pan-CDK
乳腺癌等
公司自主研发的CDK抑制剂,是公司首个小分子药物
-
JS116
KRAS
肿瘤
具有全新结构,用于治疗KRASG12C突变的非小细胞肺癌患者
-
JS007
CTLA-4
肺癌 黑色素瘤
公司自主研发的重组人源化抗CTLA-4单克隆抗体注射液
-
JS105
PI3K-α
乳腺癌 肾细胞癌
公司与润佳医药合作开发的靶向 PI3K-α 的口服小分子抑制剂
-
JS201
PD-1+TGF-β
肿瘤
公司自主研发的能同时靶向PD-1和TGF-β的双功能融合蛋白。截至目前,国内外尚无同类靶点产品获批上市
-
JS009(TAB009)
CD112R/PVRIG
肿瘤
公司自主研发的靶向CD112R的重组人源化单克隆抗体; CD112R(PVRIG)是公司发现的全新免疫检查点通路
-
JS107
Claudin18.2 ADC
消化道肿瘤
公司自主研发的注射用重组人源化抗Claudin18.2单克隆抗体MMAE偶联剂
-
JS203
CD3+CD20
肿瘤
公司自主研发的重组人源化抗CD20和CD3双特异性抗体,主要用于复发难治B细胞非霍奇金淋巴瘤的治疗。截至目前,国内尚无同类靶点产品获批上市
-
JS012
Claudin 18.2
胃癌
公司自主研发的重组人源化抗Claudin18.2单克隆抗体,拟用于治疗晚期恶性肿瘤,例如胃癌及胰腺癌等
-
JS108
TROP2 ADC
三阴性乳腺癌
抗肿瘤注射用重组人源化抗Trop2单抗-Tub196偶联剂
-
JS103
Uricase
高尿酸血症
公司自主研发的聚乙二醇化尿酸酶衍生物,主要用于高尿酸血症伴或不伴有痛风的治疗
-
JS014
IL-21
肿瘤
公司与Anwita Biosciences共同开发的重组白介素21-抗人血清白蛋白(HSA)纳米抗体融合蛋白
-
JS110
XPO1
多发性骨髓瘤等
公司与微境生物共同开发的核输出蛋白XPO1的小分子抑制剂
-
UBP1213sc
BLyS
系统性红斑狼疮
公司与迈威生物合作开发的抗BLyS单抗,用于治疗系统性红斑狼疮和其他自身免疫系统疾病
-
JT002
小核酸免疫调节剂
季节性过敏性鼻炎
公司与迈威生物合作开发的抗BLyS单抗,用于治疗系统性红斑狼疮和其他自身免疫系统疾病
-
JS111
EGFR exon 20
非小细胞肺癌
公司引进的一种有效抑制EGFR非常见突变的靶向小分子抑制剂,有望给携带EGFR exon20插入突变等EGFR非常见突变的肿瘤患者带来新的治疗方式
-
JS026
S蛋白
新型冠状病毒
公司自主研发的重组全人源单克隆抗体,主要用于COVID-19的预防和治疗
-
Tifcemalimab
BTLA
肺癌、黑色素瘤等
公司自主研发的全球首个进入临床开发阶段的抗肿瘤抗BTLA单抗。
-
JS005
IL-17A
银屑病 脊柱炎
公司自主研发的特异性抗IL-17A单克隆抗体
-
JS109
PARP
卵巢癌
公司与英派药业成立合资公司共同研发的PARP抑制剂
-
贝伐珠单抗
VEGF
非小细胞肺癌
公司通过技术许可引进的VEGF单抗,拟用于治疗转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌等癌症
-
昂戈瑞西单抗
PCSK9
高脂血症
公司自主研发、国内首个获得临床试验批件的国产抗PCSK9单克隆抗体,用于治疗原发性高胆固醇血症和混合型高脂血症
-
JT001/VV116
RdRp
新型冠状病毒
新型口服核苷类抗SARS-CoV-2药物,可抑制病毒复制
-
特瑞普利单抗
PD-1
肿瘤
公司自主研发、中国首个成功上市的国产抗PD-1单抗;荣膺国家专利领域最高奖项“中国专利金奖”
-
阿达木单抗
TNF-α
类风湿关节炎等
公司第三款商业化产品,与迈威生物合作开发
-
埃特司韦单抗
S蛋白
新型冠状病毒
公司与中科院微生物所合作开发的重组全人源抗SARS-CoV-2单克隆中和抗体,礼来制药引进了该药物在大中华区以外地区的权益,用于治疗和预防COVID-19
产品详情
- 商品名:拓益®
- 药品代号:特瑞普利单抗
- 靶点:PD-1
- 权益:自主研发
特瑞普利单抗注射液(拓益®)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。
特瑞普利单抗至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的30多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
截至目前,特瑞普利单抗已在中国获批6项适应症:用于既往接受全身系统治疗失败的不可切除或转移截至目前,特瑞普利单抗已在中国获批6项适应症:用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗(2018年12月);用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗(2021年2月);用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗(2021年4月);联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗(2021年11月);联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗(2022年5月);联合培美曲塞和铂类用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗(2022年9月)。2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有3项适应症纳入《2021年药品目录》,是国家医保目录中唯一用于治疗黑色素瘤和鼻咽癌的抗PD-1单抗药物。
在国际化布局方面,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得FDA授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。
目前,特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的生物制品许可申请(BLA)正在接受FDA审评。2022年11月,君实生物分别向欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)提交了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请(MAA)。2022年12月,EMA已受理公司提交的上市许可申请。
作用机制
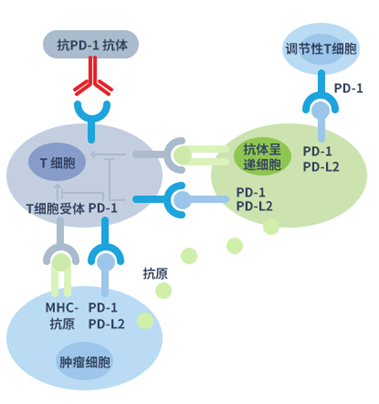
PD-1为T细胞表面受体,是T细胞共抑制信号通路的一种免疫检查点分子。如图下部分所示,当PD-1与肿瘤细胞表面的配体PD-L1/PD-L2结合,T细胞便接收抑制性信号。通过PD-1与其配体结合致使T细胞免疫失能并因此阻断抗肿瘤反应。抗PD-1单克隆抗体可阻断PD-1与PD-L1/PD-L2结合,从而使T细胞的免疫功能恢复。
主要研究文献
- 序号 期刊名称 文献标题 发表时间 链接
- 1 Nature Medicine Toripalimab or placebo plus chemotherapy as first-line treatment in advanced nasopharyngeal carcinoma: a multicenter randomized phase 3 trial 2021 打开链接
- 2 Signal Transduction and Targeted Therapy Toripalimab plus chemotherapy as second-line treatment in previously EGFRTKIs treated patients with EGFR-mutant advanced NSCLC: a multi-center phase II trial 2021 打开链接
- 3 Journal of Clinical Oncology Efficacy, Safety, and Correlative Biomarkers of Toripalimab in Previously Treated Recurrent or Metastatic Nasopharyngeal Carcinoma: A Phase II Clinical Trial (POLARIS-02) 2021 打开链接
- 4 JAMA Network Open Safety, Antitumor Activity, and Pharmacokinetics of Toripalimab, a Programmed Cell Death 1 Inhibitor, in Patients With Advanced Non–Small Cell Lung Cancer A Phase 1 Trial 2020 打开链接
- 5 Cancer Communications A Phase I Study of Toripalimab, an anti-PD-1 Antibody, in Patients With Refractory Malignant Solid Tumors 2020 打开链接
- 6 Clinical Cancer Research Safety, Efficacy and Biomarker Analysis of Toripalimab in previously treated advanced melanoma: results of the POLARIS-01 multicenter phase II trial 2020 打开链接
- 7 European Journal of Cancer Safety and clinical efficacy of toripalimab, a PD-1 mAb, in patients with advanced or recurrent malignancies in a phase I study 2020 打开链接
- 8 mABs Glycosylation-independent binding of monoclonal antibody toripalimab to FG loop of PD-1 for tumor immune checkpoint therapy 2019 打开链接
- 9 Acta Pharmacologica Sinica Preclinical evaluation of the efficacy, pharmacokinetics and immunogenicity of JS-001 2017 打开链接
- 10 Clinical Cancer Research Efficacy, safety and biomarkers of toripalimab in patients with recurrent or metastatic neuroendocrine neoplasms:a multiple-center phase Ib trial 2020 打开链接
- 11 Journal of Clinical Oncology Axitinib in Combination With Toripalimab, a Humanized Immunoglobulin G4 Monoclonal Antibody Against Programmed Cell Death-1, in Patients With Metastatic Mucosal Melanoma: An Open-Label Phase IB Trial 2019 打开链接
- 12 Annals of Translational Medicine JS001, an anti-PD-1 mAb for advanced triple negative breast cancer patients after multi-line systemic therapy in a phase I trial 2019 打开链接
- 13 Annals of Oncology Safety, efficacy and tumor mutational burden as a biomarker of overall survival benefit in chemorefractory gastric cancer treated with toripalimab, a PD1 antibody in phase Ib/II clinical trial NCT02915432 2019 打开链接
- 14 Journal of Hematology & Oncology Safety and clinical activity with an anti-PD-1 antibody JS001 in advanced melanoma or urologic cancer patients 2019 打开链接